这是一份关于坦桑尼亚药品和医疗设备管理局(TMDA)主导的药品注册流程的概述: 该流程包括由乌干达国家药品管理局(GMP lead)领导的31次联合GMP检查,以及向坦桑尼亚药品和医疗设备管理局提交申请。经过筛选和验证,验证GMP状态,进行初步审查和同行审查,最终由EAC秘书处发布最终EAC推荐注册。向申请人发送确认函,发送问题清单,批准国家级别,并在最多90天内发放营销授权证书。对于EAC伙伴国的NRAs,可应要求提供适用费用。
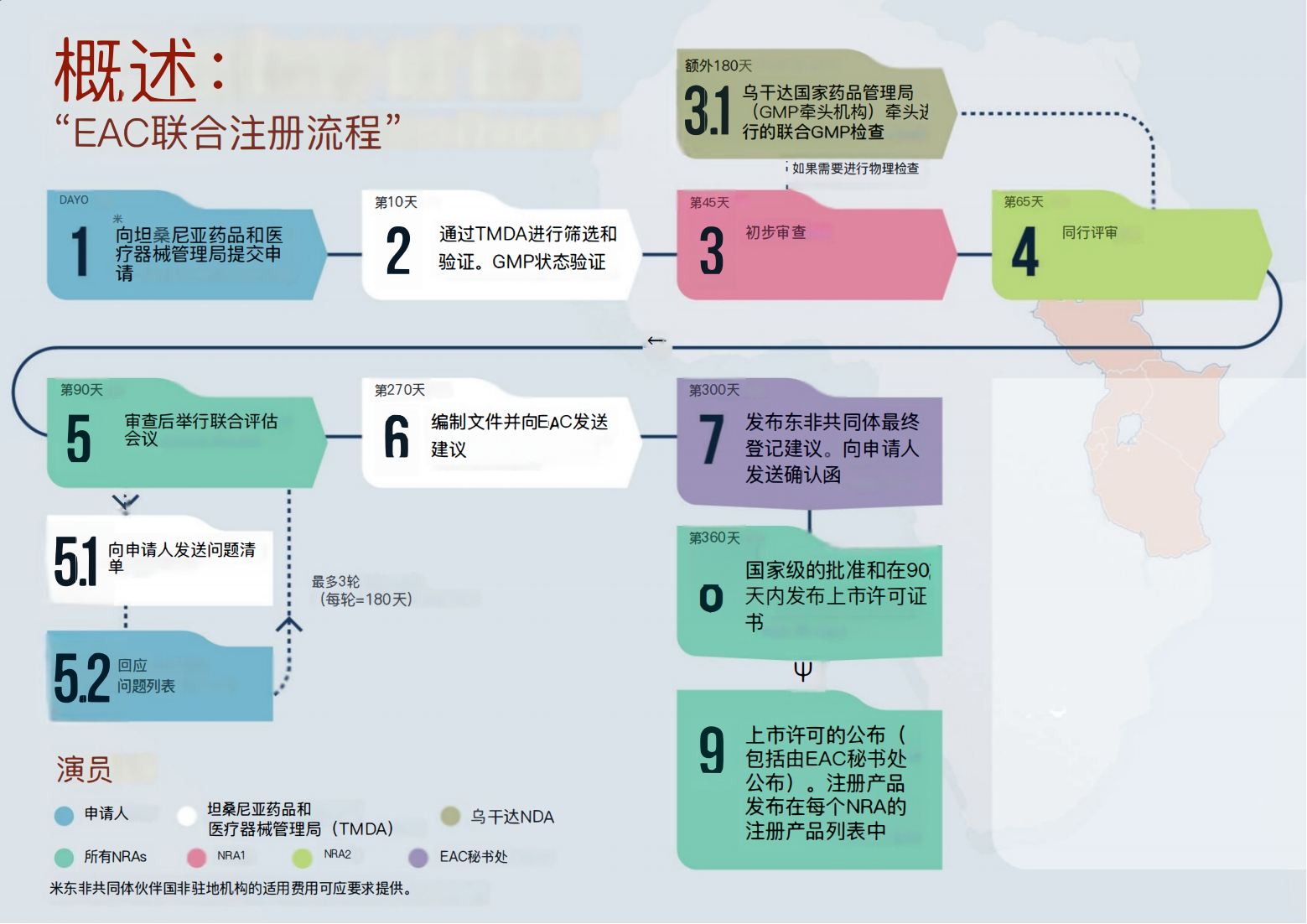
这是一份关于坦桑尼亚药品和医疗设备管理局(TMDA)主导的药品注册流程的概述: 该流程包括由乌干达国家药品管理局(GMP lead)领导的31次联合GMP检查,以及向坦桑尼亚药品和医疗设备管理局提交申请。经过筛选和验证,验证GMP状态,进行初步审查和同行审查,最终由EAC秘书处发布最终EAC推荐注册。向申请人发送确认函,发送问题清单,批准国家级别,并在最多90天内发放营销授权证书。对于EAC伙伴国的NRAs,可应要求提供适用费用。



