对于新药的申请注册,DMF是必不可少的。在美国医药注册成功后有很大的权威性,所以很多药企都会选择在美国进行医药注册 ,所以以下介绍一下DMF的申请过程,以便企业需要。
药品主文件,Drug Master File(简称DMF),是关于产品化学、生产和质量控制信息的一套完整文件资料,内容包括产品的一般信息、生产工艺、杂质研究、稳定性等方面的资料和数据。DMF可作为一种或多种临床研究申请、创新药申请、简化新药申请、出口申请以及上述各种申请的变更或补充,还可以作为另一个DMF的参阅性文件。根据美国《食品、药品和化妆品法》(The Food, Drug and Cosmetic Act)、《美国联邦管理法第21卷》(Code of Federal Regulations Title 21)和《DMF指南》(Drug Master Files Guidance for Industry)等法律法规, DMF不是强制性的,当原料药、辅料和包装容器等生产商在不愿意将自己产品的技术信息泄露给非官方的第三方时,可将其技术信息以DMF文件的形式提交给美国食品药品监督管理局(FDA),获得登记号并存档。DMF归档后制剂商可以直接以DMF归档号代替制剂申请资料中本来应该包含的原料药、辅料和包装容器技术信息,一方面简化了制剂申请的内容,另一方面解决了原料药、辅料和包装容器生产商对信息保密的需求。
DMF的状态有两种:
“A”=Active:激活状态,表示该DMF已获得登记号(归档号或备案号)并被正常维护,可用;
“I”=Inactive:未激活状态,表示该DMF已被持有人或FDA关闭,不可用。
企业义务及应对策略
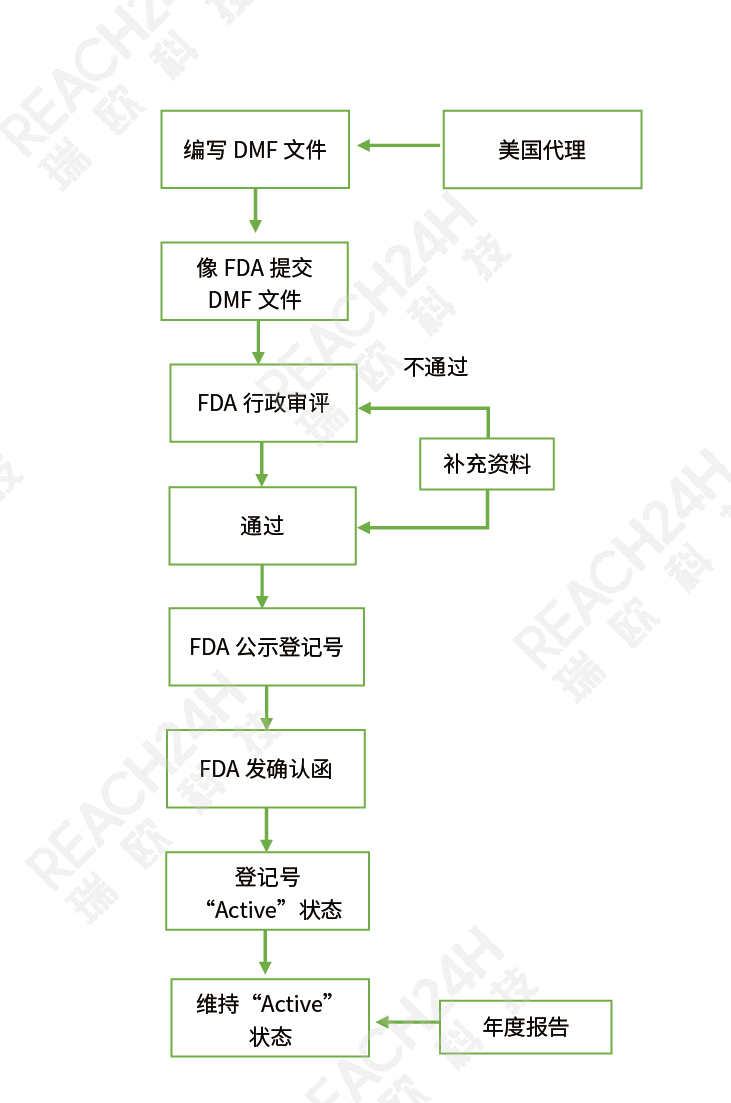
原辅包生产商以持有人身份将技术信息以文件的形式提交给美国食品药品监督管理局(FDA)进行DMF登记,官方建议境外生产企业通过美国代理进行DMF登记,保持与FDA联络及处理相关注册事宜。
登记目标:DMF登记后通过行政审评的原辅包拿到 “A”状态的登记号,与制剂关联审评时通过技术审评,登记号的状态维持“A”不变;其中支持ANDA上市的DMFII类原料药在通过行政审评后必须再通过完整性审评才能与制剂关联进行技术审评。
注册登记及流程
登记类型
FDA对DMF有以下分类:
Type I型:生产厂址、设施与设备、标准操作程序和人员*;
Type II型:原料药、中间体及其使用的原料,或药物制剂;
Type III型:包装材料/容器;
Type IV型:辅料/赋形剂,着色剂,香料及其使用的原料;
Type V型:可被FDA接受的其它信息。
*注:2000年后,FDA已不再接收Type I型DMF文件。
登记资料要求
DMF登记资料使用e-CTD格式递交;其中III类DMF可以选择纸质版和e-CTD格式递交,纸质版关闭节点在2022年2月;电子版的DMF可通过FDA的ESG(Electronic Submission Gateway)递交,对于超过10GB的注册资料,可用物理媒介递交,例如光盘等。
登记流程