对于老挝的医疗器械注册问题,很多企业或许不是很明白。老挝作为欠发达地区,老挝政府对于医药行业的发展也是大力的扶持。所以本篇为大家带来老挝医疗器械注册的指南。
医疗器械定义
国务院2017年05月19日修订颁布的《医疗器械监督管理条例》对医疗器械有这样一个定义,即医疗器械是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用;其目的是:
l 疾病的诊断、预防、监护、治疗或者缓解;
l 损伤的诊断、监护、治疗、缓解或者功能补偿;
l 生理结构或者生理过程的检验、替代、调节或者支持;
l 生命的支持或者维持。
l 妊娠控制
l 通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
医疗器械注册指南
医疗器械注册是申请人向药品监督管理部门提出申请,药品监督管理部门根据现行法律法规,对申请企业所申请的医疗器械产品的安全性及有效性进行科学系统的评价,然后进行审批决定是否准予许可的过程。
老挝进口医疗器械注册适用法规:
1. 20201221-《医疗器械监督管理条例》(NMPA2021修订版)
2. 20141001-《医疗器械注册管理办法》(CFDA令第4号)
3. 20141001-《医疗器械说明书和标签管理规定》(CFDA令第6号)
4. 20140530-CFDA关于发布医疗器械产品技术要求编写指导原则的通告(第9号)
5. 20141001-CFDA关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(2014年第43号)
老挝进口医疗器械注册分类监管情况:
第二类医疗器械,风险适中。
第三类医疗器械,风险较高。
进口产品统一向国家药品监督管理部门提交申请。
香港、澳门、台湾地区医疗器械注册、备案,参照进口医疗器械管理,向国家药品监督管理部门提交申请。
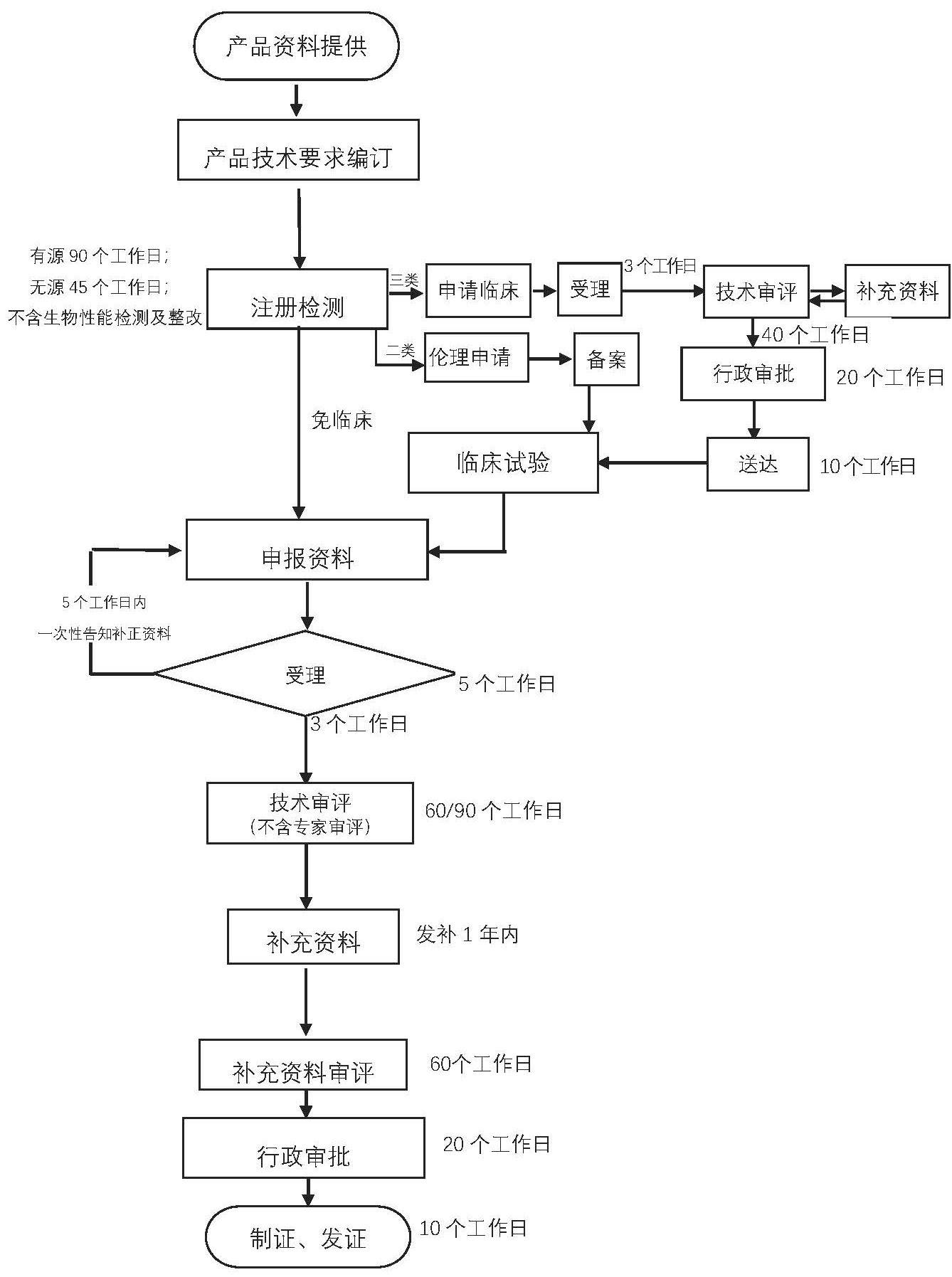
老挝进口医疗器械注册的基本流程:
医疗器械注册流程:
老挝进口医疗器械注册流程:
1. 可行性评估
2. 样品检验(省级以上医疗器械检测所)
3. 临床评价(豁免临床对比/同品种临床评价/临床试验)
4. 准备申报材料
5. 行政服务大厅受理或CA申请受理
6. 技术审评中心审评
7. 许可决定
8. 批件送达
老挝进口医疗器械注册的详细流程:
老挝进口医疗器械注册的基本要求
《医疗器械监督管理条例》(国务院令 第680号)第八条:“第一类医疗器械实行产品备案管理,第二类、第三类医疗器械实行产品注册管理。”第九条:“第一类医疗器械产品备案和申请第二类、第三类医疗器械产品注册,应当提交下列资料:(一)产品风险分析资料;(二)产品技术要求;(三)产品检验报告;(四)临床评价资料;(五)产品说明书及标签样稿;(六)与产品研制、生产有关的质量管理体系文件;(七)证明产品安全、有效所需的其他资料。医疗器械注册申请人、备案人应当对所提交资料的真实性负责。”第十一条:“向我国境内出口第二类、第三类医疗器械的境外生产企业,应当由其在我国境内设立的代表机构或者指定我国境内的企业法人作为代理人,向国务院食品药品监督管理部门提交注册申请资料和注册申请人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。第二类、第三类医疗器械产品注册申请资料中的产品检验报告应当是医疗器械检验机构出具的检验报告;临床评价资料应当包括临床试验报告,但依照本条例第十七条的规定免于进行临床试验的医疗器械除外。”)
2.《医疗器械注册管理办法》(国家食品药品监督管理总局令 第4号)第五章 产品注册
3.关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(国家食品药品监督管理总局公告 2014年 第43号 )附件4:医疗器械注册申报资料要求及说明;附件8:医疗器械安全有效基本要求清单
老挝进口医疗器械注册的申请资料(仅供参考):
2.《医疗器械注册管理办法》(国家食品药品监督管理总局令 第4号)第五章 产品注册
3.关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(国家食品药品监督管理总局公告 2014年 第43号 )附件4:医疗器械注册申报资料要求及说明;附件8:医疗器械安全有效基本要求清单
老挝进口医疗器械注册的申请资料(仅供参考):
老挝进口二三类医疗器械注册资料:
1.申请表
2.证明性文件
3.医疗器械安全有效基本要求清单
4.综述资料
5.研究资料
6.生产制造信息
7.临床评价资料
8.产品风险分析资料
9.产品技术要求
10.产品注册检验报告
11.说明书和标签样稿
12.符合性声明
13.其他文件
老挝进口医疗器械注册申报资料要求:
依据《境内第三类和进口医疗器械注册审批操作规范》(食药监械管[2014]208号)的要求,进口产品申报资料,如无特别说明,原文资料均应由申请人签章,中文资料由代理人签章。原文资料“签章”是指:申请人法定代表人或者负责人签名,或者签名并加盖组织机构印章,并且应当提交由申请人所在地公证机构出具的公证件。
更多注册的服务,可咨询网站右侧二维码。

想要下载更多资料,请您添加微信了解详情!
微信号:csco2022
公众号:康安医药咨询




