-
国内创新药临床登记流程
康安医药咨询
新药研发是一个非常具有风险的过程,好在现在大环境下。国家对于新药的研发是比较鼓励的,所以现在有众多的企业都开始研发,所以国内相应的制度,法律法规现在也是非常的完善。在此将全部过程展示,以便需要者查阅。
新药研发是一个非常具有风险的过程,好在现在大环境下。国家对于新药的研发是比较鼓励的,所以现在有众多的企业都开始研发,所以国内相应的制度,法律法规现在也是非常的完善。在此将全部过程展示,以便需要者查阅。
法规概述
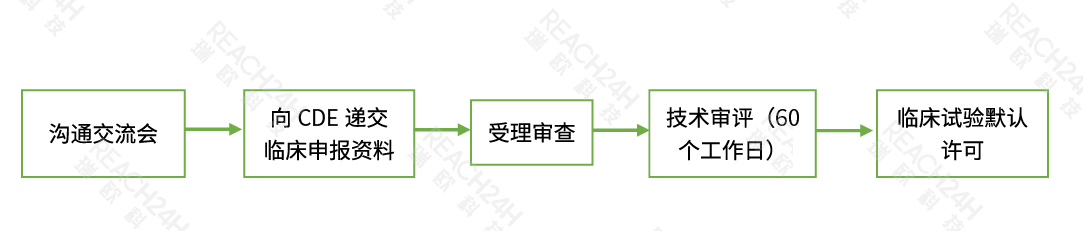
2018年NMPA发布《国家药品监督管理局关于调整药物临床试验审评审批程序的公告(2018年第50号)》,标志着我国药物临床试验管理由审评审批制度转变为60日默示许可制,依据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》和《药品注册管理办法》等法律法规,在提出药物临床试验申请前,申请人应完成支持药物临床试验的药学、药理毒理学等研究。申请人按照申报资料要求提交相关研究资料至CDE,申报资料符合形式要求的,予以受理。受理之日起六十日内完成技术审评,并通知申请人审评结果;逾期未通知的,视为同意。获准开展药物临床试验的,申办者在开展后续分期药物临床试验前,应当制定相应的药物临床试验方案,经伦理委员会审查同意后开展。
企业义务及应对策略
申请人依法向国家药品监督管理局药品审评中心(CDE)提出临床试验注册申请。境内临床试验申请人是在中华人民共和国境内合法登记并能独立承担相应法律责任的企业或者药品研制机构等;境外申请人应当是境外合法制药厂商,境外申请人应当指定中国境内的企业法人办理相关药品注册事项。
获得批准后,申办者应当在开展药物临床试验前在药物临床试验登记与信息公示平台登记药物临床试验方案等信息。研发期间安全性更新报告应当每年提交一次,于药物临床试验获准后每满一年后的两个月内提交;药物临床试验期间,申办者应当持续更新登记信息,并在药物临床试验结束后登记药物临床试验结果等信息。
登记目标:获得开展临床试验的许可。申请人获准开展药物临床试验的为药物临床试验申办者
注册登记及流程
登记类型
申请开展临床试验的新药;获准开展药物临床试验的药物拟增加适应症;获准上市的药品拟增加适应症
登记资料要求
登记流程
导航



