-
关于国内创新药生产注册申报流程
康安医药咨询
目前国内对于新药的研发生产处于大力支持阶段,所以很多的医药行业在迅速地发展。但是怎么进行注册申报也成了新创业人员的咨询点。所以在此带来相关的情况,以便大家了解。
目前国内对于新药的研发生产处于大力支持阶段,所以很多的医药行业在迅速地发展。但是怎么进行注册申报也成了新创业人员的咨询点。所以在此带来相关的情况,以便大家了解。
法规概述
依据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》和《药品注册管理办法》等法律法规,创新药药品上市前,应当完成药学、药理毒理学和药物临床试验等相关研究工作。创新药申请人按要求向国家药品监督管理局药品审评中心(CDE)提出上市申请,经CDE受理并完成技术审评后转国家药品监督管理局(NMPA)决定是否批准。
企业义务及应对策略
申请人依法向国家药品监督管理局药品审评中心(CDE)提出创新药生产/上市注册申请。
进口或国产创新药,境内申请人是在中华人民共和国境内合法登记并能独立承担相应法律责任的机构或人员;境外申请人应当是境外合法制药厂商,境外申请人应当指定中国境内的企业法人办理相关药品注册事项。
注册目标:获取《进口药品注册证》/《医药产品注册证》或药品批准文号。申请人取得药品注册证书后,为药品上市许可持有人。
注册及登记流程
注册类型
进口或国产创新药,药品注册按照中药、化学药和生物制品等进行分类注册管理。
注册资料要求
中药应符合《国家药监局关于发布中药注册分类及申报资料要求的通告》(2020年第68号)中的要求。
化学药应符合《国家药监局关于发布化学药品注册分类及申报资料要求的通告》(2020年第44号)中的要求。
生物制品应符合《国家药监局关于发布生物制品注册分类及申报资料要求的通告》(2020年第43号)中的要求。
注册流程
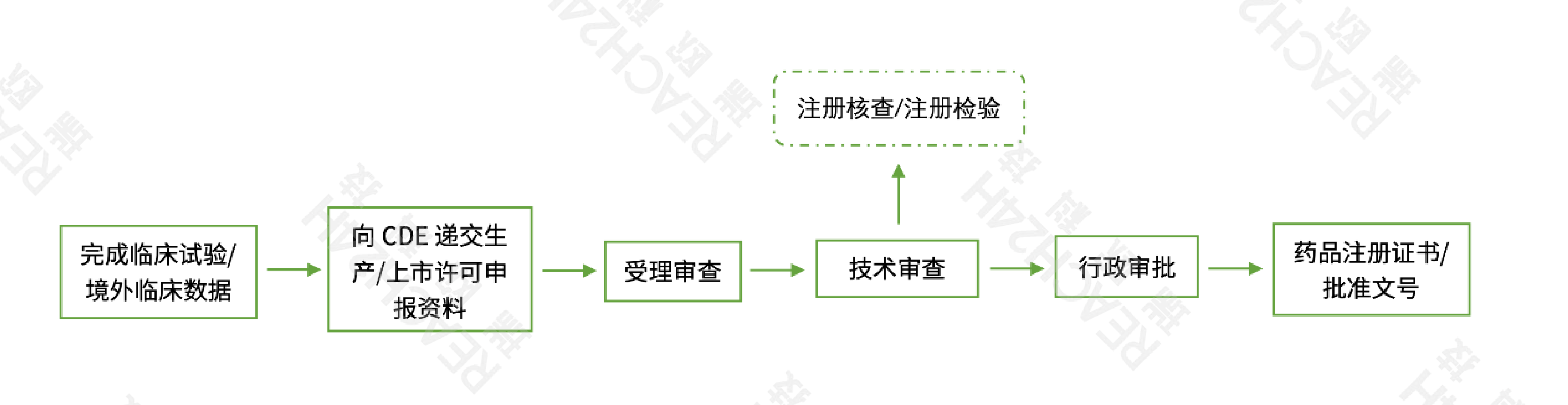
注:根据技术审评需要进行现场核查和注册检验
我们的服务
根据中国法规要求,分析该品种在中国进行药品注册的可行性(包括是否适用于加快上市注册程序)
提供申报资料大纲目录
对注册资料进行差距分析,结合品种信息进行预审,对客户提出修改建议
CTD格式注册资料的审核、翻译、编写、递交
注册检验送样、申请、跟踪和问题解决
药品注册官方全程跟踪,CDE发补问题解答及补充回复资料递交。
我们康安医药咨询的优势
专业——复合型的法规咨询团队,拥有数十年中、美、欧药品法规研究经验,确保专业的技术咨询服务
高效——项目配置专属技术与商务顾问,确保客户需求得到及时响应,竭诚为客户创造合规价值
品质——丰富的咨询项目经验和规范的服务流程管理,以及中、英、日多语言咨询服务能力,确保高品质服务过程和良好的客户体验
资源——和官方及行业专家建立长期友好的沟通渠道,显著提高服务质量和效率
导航



